Un nouveau mode de classement des mutations provoquant le cancer pourrait permettre de mieux adapter les traitements aux patients
Jacqulyne Robichaux, Assistant Professor of Thoracic & Head and Neck Oncology, The University of Texas MD Anderson Cancer Center
Il existe de nombreux types de traitements contre le cancer. Mais ceux qui fonctionnent le mieux varient d’un patient à l’autre. Actuellement, les médecins déterminent le traitement à tenter pour un patient en fonction de l’endroit où se trouve, dans son ADN, ou code génétique, l’erreur qui a provoqué le cancer.
Mais une nouvelle approche qui regroupe les patients en fonction des modifications de la structure et de la fonction des protéines causées par cette erreur, plutôt qu’en fonction de l’emplacement des modifications de l’ADN, pourrait conduire à des essais cliniques plus complets et à de meilleurs traitements pour les patients.
Je fais partie d’une équipe qui étudie les thérapies ciblées pour le cancer et les moyens de rendre le traitement plus spécifique au patient. Une étude récente de notre équipe de recherche a déterminé que le regroupement des erreurs d’ADN par structure pourrait permettre de mieux personnaliser les traitements contre le cancer.
Les thérapies ciblées s’attaquent aux cellules cancéreuses
Les mutations sont des erreurs commises au cours de la réplication cellulaire, lorsque le matériel génétique de cette cellule, ou ADN, fabrique une nouvelle copie de lui-même. Ces mutations sont généralement inoffensives et sont détectées par le mécanisme de correction de la cellule.
Cependant, il arrive que le correcteur échoue. Et dans de rares cas, ces mutations se produisent dans des parties de l’ADN appelées oncogènes. Dans des conditions normales, les oncogènes sont essentiels à la croissance et au développement normaux, comme le développement des organes du fœtus et la réparation et l’entretien des tissus généraux. Mais lorsque des mutations font que les oncogènes signalent une croissance hors contrôle, un cancer peut apparaître.
Une façon de tuer ces cellules tumorales est d’utiliser une thérapie ciblée. Les thérapies ciblées du cancer se lient spécifiquement aux protéines défectueuses produites par les oncogènes mutés et les empêchent d’envoyer un signal de « croissance ».
Étant donné que les thérapies ciblées se lient directement à la protéine cancéreuse, elles évitent d’endommager la plupart des cellules non cancéreuses. Il en résulte une destruction plus spécifique des cellules cancéreuses et une moindre toxicité globale du traitement. En revanche, la chimiothérapie s’attaque à toutes les cellules qui se divisent activement, ce qui inclut non seulement le cancer mais aussi les follicules pileux, le tube digestif et d’autres parties du corps.
Pour rendre les thérapies ciblées plus spécifiques, les scientifiques étudient souvent les modifications physiques ou structurelles que les mutations génèrent dans les protéines. Ils conçoivent des médicaments qui se lient préférentiellement à ces modifications particulières pour empêcher la protéine défectueuse de provoquer une croissance incontrôlée.
Cependant, comme les mutations peuvent se produire dans de nombreuses zones différentes d’une protéine, plusieurs thérapies ciblées sont souvent nécessaires pour se lier à toutes les mutations différentes qui se produisent dans les différents types de cancer. Cela conduit à un problème clinique difficile : comment les médecins font-ils correspondre les patients à la thérapie ciblée la plus efficace pour leurs mutations ?
Les traitements traditionnels utilisent la localisation des mutations
Pour tenter de répondre à cette question, notre équipe de recherche a choisi de se concentrer sur un oncogène du cancer du poumon, l’EGFR, ou récepteur du facteur de croissance épidermique. Nous l’avons fait pour deux raisons. Premièrement, le cancer du poumon reste la première cause de décès liés au cancer dans le monde. Deuxièmement, les mutations de l’EGFR figurent parmi les formes les plus courantes de cancer du poumon. Elles se produisent dans environ un tiers des cancers du poumon non à petites cellules dans le monde, ce qui représente plus de 550 000 patients par an.
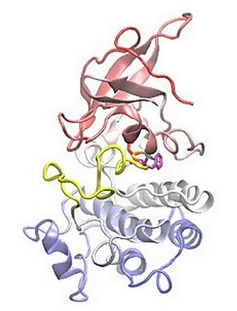
L’EGFR présente de nombreuses mutations différentes qui provoquent une croissance non régulée. Plusieurs générations de thérapies ciblées sont disponibles pour cette population de patients.
Les essais cliniques et les options de traitement pour les patients atteints d’un cancer du poumon induit par un oncogène, en particulier l’EGFR, sont actuellement basés sur le type et la localisation de la mutation dans l’ADN.
Cependant, la localisation de la mutation n’est pas la meilleure approche pour prédire la réponse des patients à un médicament. Comme les mutations changent la forme d’une protéine, elles peuvent modifier la façon dont les thérapies ciblées interagissent avec la protéine.
Les mutations de l’EGFR, l’un des oncogènes subissant le plus fréquemment des mutations dans le cancer du poumon, modifient la forme de la protéine, ce qui affecte directement son fonctionnement.
F. Gervasio/UCL Chimie et ISMB, CC BY
Regrouper les mutations du cancer
En examinant les structures ayant subi des mutations dans les différentes protéines EGFR, notre équipe a constaté qu’elles pouvaient être classées en sous-groupes distincts.
Par exemple, nous avons constaté que les mutations qui se forment loin des zones de la protéine que les médicaments ciblent n’affectent pas sensiblement la capacité du médicament à se lier à la protéine. Les cellules présentant ce type de mutation protéique étaient donc tuées par tous les types d’inhibiteurs de l’EGFR. Bien que ces mutations se soient produites à de nombreux endroits dans l’ADN, elles avaient le même effet structurel et fonctionnel global sur les protéines.
À l’inverse, les mutations qui se forment près des zones cibles typiques des médicaments compriment cette région et empêchent certains inhibiteurs de l’EGFR de se fixer à la protéine. Ces mutations se sont également produites à plusieurs endroits différents de l’ADN.

Sur la base de ces résultats, notre équipe a émis l’hypothèse que les modifications structurelles dans des régions protéiques similaires, et non la localisation de l’ADN, entraîneraient des modifications similaires de l’efficacité d’un médicament.
Pour vérifier notre hypothèse, nous avons analysé rétrospectivement des données publiques et hospitalières sur la réponse des patients aux traitements contre le cancer. Nous avons classé les patients en groupes traditionnels basés sur la localisation de l’ADN et en sous-groupes nouvellement définis basés sur la structure/fonction pour déterminer si un groupe comptait plus de patients répondant mieux que l’autre à différents médicaments.
Nous avons constaté que les sous-groupes basés sur la structure/fonction identifiaient près de deux fois plus de patients qui bénéficiaient d’un médicament particulier que les groupes basés sur la localisation de l’ADN. Le regroupement des patients en fonction de la structure/fonction a également permis de déterminer quel inhibiteur de l’EGFR apportait le plus grand bénéfice clinique aux patients.
Plus d’essais cliniques inclusifs
Outre le fait qu’ils peuvent potentiellement orienter les patients vers des traitements plus efficaces, les essais cliniques utilisant des sous-groupes basés sur la structure peuvent permettre un accès plus large aux traitements.
Les essais cliniques actuels excluent jusqu’à un cinquième des patients atteints d’un cancer du poumon non à petites cellules avec mutation de l’EGFR, car chaque essai clinique ne porte généralement que sur une poignée de types de mutation spécifiques. En recadrant les études cliniques pour qu’elles soient basées sur les modifications que les mutations entraînent dans la structure et la fonction des protéines, par opposition à leur emplacement sur l’ADN, on pourrait élargir les options de traitement pour inclure les patients atteints de cancers avec mutationde l’EGFR plus rares.
Cette approche fournit un cadre que les essais cliniques pourraient utiliser pour rendre les études plus inclusives de tous les types de mutations. Elle pourrait également permettre d’identifier des sous-groupes de mutations précédemment ignorés ou cachés qui pourraient conduire à la mise au point de nouveaux médicaments et, en fin de compte, améliorer les soins aux patients.
Traduction : Citizen4Science – lien vers l’article original