Paxlovid : le point complet de Claude-Alexandre Gustave
par Claude-Alexandre GUSTAVE, biologiste médical
NB : notre précédent point Paxlovid date de janvier 2022;
Nature, fonctionnement, intérêt et limites de ce médicament anti-Covid par voie orale
Paxlovid c’est quoi ?
Paxlovid est un médicament antiviral produit par Pfizer.
Il contient notamment :
– 1 principe actif, le nirmatrelvir (qui agit comme un anti-protéase, on en reparlera)
– 1 adjuvant, le ritonavir (qui agit comme un modulateur métabolique)
Pfizer ayant partagé son brevet, il existe déjà sous forme générique (= Bexovid).
Le principe actif et adjuvant restent les mêmes ; ce sont les excipients, producteurs et distributeurs qui changent (accessoirement le prix baisse, ce qui facilite l’accès pour certains pays)
Ritonavir
C’est une molécule utilisée notamment comme antirétroviral contre le VIH.
Il est utilisé ici, non pas comme antiviral, mais pour ses propriétés de modulation de notre métabolisme…
Le ritonavir est capable d’inhiber un complexe enzymatique appelé cytochrome P450 (CYP) 3A4, impliqué dans le catabolisme et l’élimination de certains xénobiotiques (et en l’occurrence du nirmatrelvir, principe actif de Paxlovid)…
En clair, le ritonavir sert à ralentir notre métabolisme, afin que nous éliminions plus lentement le nirmatrelvir (ce qui permet de réduire/espacer les doses).
Le ritonavir sert donc uniquement à augmenter la biodisponibilité de Paxlovid.
Nirmatrelvir
C’est le principe actif, l’antiviral de Paxlovid ; et plus précisément un inhibiteur compétitif peptidomimétique de protéase (on en reparlera un plus loin)…
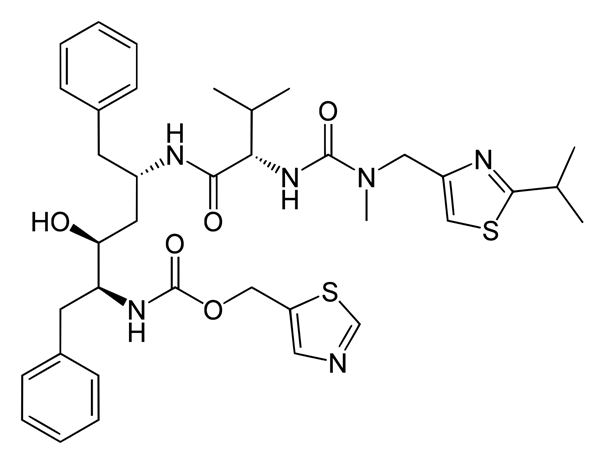
L’origine du nirmatrelvir remonte aux travaux de 2 laboratoires :
A) Pfizer sur SARS-CoV (en 2002-2003)
B) Anivive Lifesciences sur la péritonite infectieuse féline (maladie à Coronavirus FCoV, souvent mortelle chez les chats et autres félidés).
Anivive Lifesciences développe une molécule, appelée GC376, dirigée contre FCoV.
In vivo, elle est métabolisée (groupement bisulfite 🔴 remplacé par un groupement aldéhyde 🔵) pour conduire à la molécule active GC373
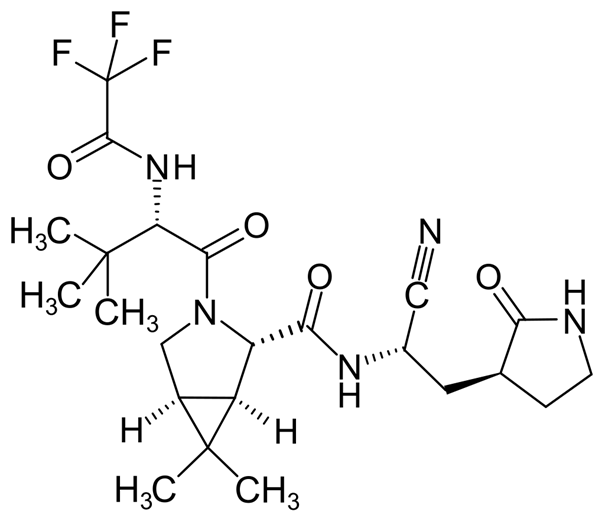
Pfizer a développé un analogue de GC373, appelé PF-07304814 (ou lufotrelvir).
L’inconvénient du lufotrelvir était sa voie d’administration, limitée à la voie intraveineuse
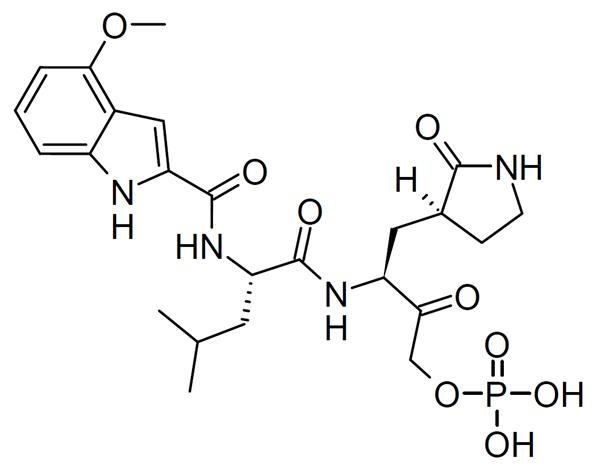
In vivo, ce lfotrelvir est lui aussi métabolisé par élimination du groupement phosphate.
Cela aboutit au métabolite actif, appelé PF-00835231
(métabolite actif du lufotrelvir, capable d’inhiber la protéase « Mpro » des Coronavirus)
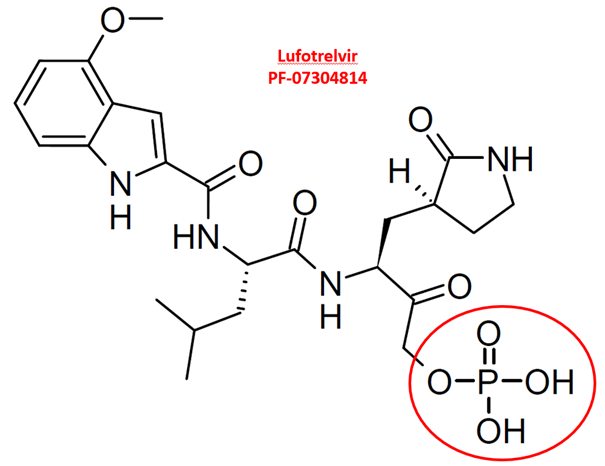
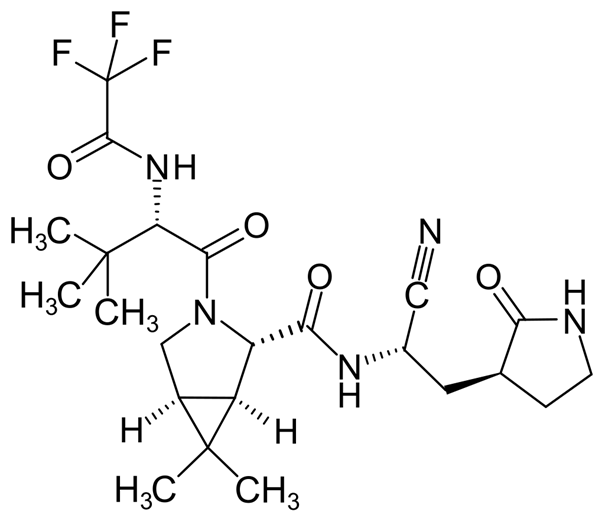
Pfizer a développé le « petit frère » du lufotrelvir, mais cette fois administrable par voie orale (= pro-drogue).
Il s’agit du PF-07321332… Anti-protéase de 2ème génération, désormais mieux connu sous le nom de nirmatrelvir = principe actif du Paxlovid/Bexovid 🤷♂️
Sans avoir un œil exercé de chimiste/pharmacologue, vous avez peut-être remarqué que toutes ces molécules ont un peu la « même tête » .
En chimie thérapeutique c’est courant, car la structure d’un principe actif dépend de ses groupements chimiques fonctionnels…
En l’occurrence, toutes ces molécules portent les groupements suivants :
A) « warhead » (ou « ogive ») = site actif de la molécule ;
B) résidus P1, P2 et P3/P4 qui déterminent la stabilité, l’affinité et la spécificité de cible
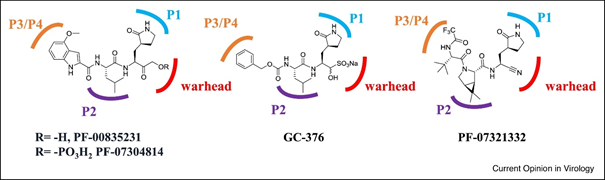
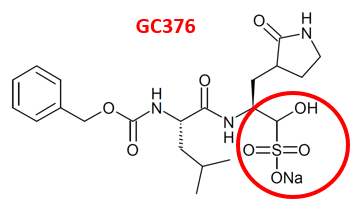
Le groupe GC376/GC373 n’a pas été retenu pour le développement clinique contre la COVID, par manque de spécificité pour la « Mpro » de SARS-CoV-2.
L’inhibition de nos propres protéases (notamment cathepsine B et L) pouvant réduire notre réponse immunitaire et/ou être cancérogène.
Le groupe PF-07304814 (lufotrevir) / PF-00835231 n’a pas été retenu non plus en raison de ses caractéristiques chimiques imposant une administration par voie intraveineuse (donc plutôt en gestion hospitalière… moins compatible avec une administration précoce).
C’est donc le PF-07321332 (nirmatrelvir) qui a été développé avec plusieurs optimisations chimiques afin d’↗️ sa stabilité, sa spécificité pour la Mpro de SARS-CoV-2, et permettre une administration par voie orale…
Mécanisme d’action de Paxlovid
Pour comprendre le rôle de ces optimisations, il faut d’abord revenir à la cible du nirmatrelvir = « Mpro » (pour « main protease », ou « protéase principale »).
Elle porte aussi le nom de « 3CLpro » (pour « 3C-like protease »).
Ou encore nsp5 (pour « non-structural protein 5 »)…
Et pour comprendre son action, il faut revenir à la structure/cycle de SARS-CoV-2 !
En bref, c’est un Betacoronavirus du sous-genre Sarbecovirus (aucun autre ne circule chez l’Homme).
Ses virions sont enveloppés et criblés de spicules (S)
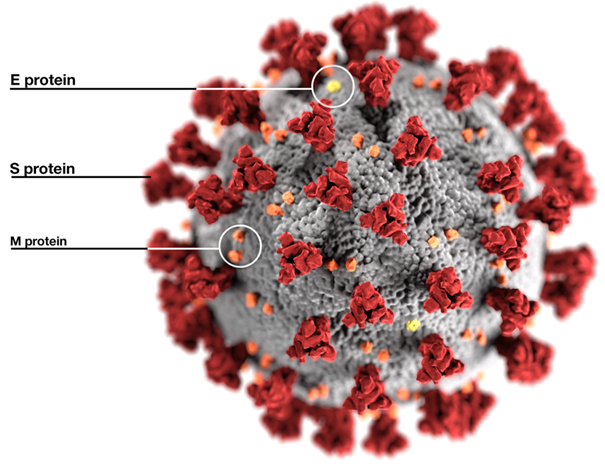
L’extérieur des virions porte aussi la protéine d’enveloppe (E), et l’extrémité de la protéine de matrice (M) émerge aussi à la surface. Sous l’enveloppe, on trouve une autre protéine structurale constituant la nucléocapside (N)…
L’intérieur des virions contient aussi diverses protéines non-structurales (essentiellement des enzymes), ainsi que le génome viral = ARN monocaténaire de polarité positive (signifie notamment qu’il peut être directement traduit en protéines virales dès l’entrée dans la cellule)…
Ce génome viral est donc infectieux même sous une forme libre hors du virion (puisqu’il peut initier le cycle de réplication en étant directement pris en charge par notre machinerie cellulaire comme un simple « ARN messager ») !…
Et dans ce génome viral, on trouve d’une part les gènes codant les protéines structurale (S, E, M et N), ainsi que 2 ORFs (Open Reading Frames, ou « cadres de lecture ouverte ») pouvant être traduits en 16 protéines non-structurale
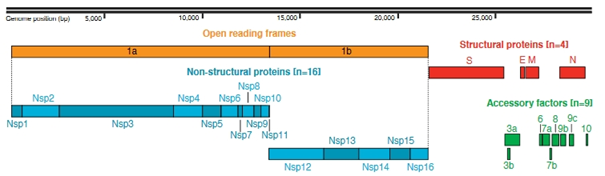
Une particularité de ces génomes ARN+ monocaténaires, est qu’ils sont initialement traduits « d’un bloc » en polyprotéines couvrant plusieurs ORFs/gènes.
Elles sont alors non-fonctionnelles, jusqu’à l’entrée en jeu de… protéases virales !
Chez SARS-CoV-2, l’ARN viral est traduit en 2 polyprotéines appelées pp1a et pp1ab.
2 protéases virales entrent alors en jeu :
A) nsp3 (PLpro) = 3 sites de clivage = libère nsp1 à nsp3
B) nsp5 (3CLpro, Mpro) = 11 sites de clivage = libère nsp4 à 16
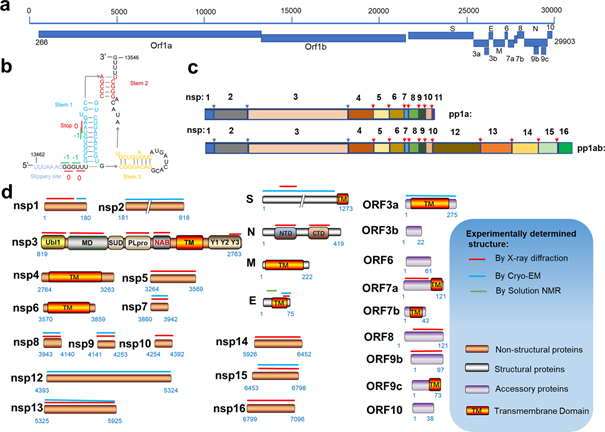
La protéase qui nous intéresse particulièrement c’est « nsp5 » (fameuse Mpro ou 3CLpro) = cible du Paxlovid.
Son rôle est crucial pour la poursuite du cycle de réplication virale, en permettant la libération/activation des protéines virales… Nsp5 a donc pour fonction de cliver ces polyprotéines pour libérer chacune des protéines, qui pourront alors acquérir leur structure 3D et leur activité fonctionnelle !
En d’autres termes, sans nsp5 (bloquée par Paxlovid), le cycle viral tourne court.
Maintenant vous savez d’où vient l’appellation « Mpro » (pour « Main protease ») !
C’est cette protéase qui initie la construction des autres protéines virales (incluant d’autres protéases…).
Mais comment fonctionne-t-elle ? Et comment est-elle bloquée par Paxlovid ?
Du point de vue enzymatique, cette protéase fonctionne comme un homodimère (2 sous-unités identiques), très conservé entre les genres/espèces de Coronavirus, chargé de cliver les polyprotéines produites lors du cycle de réplication virale…
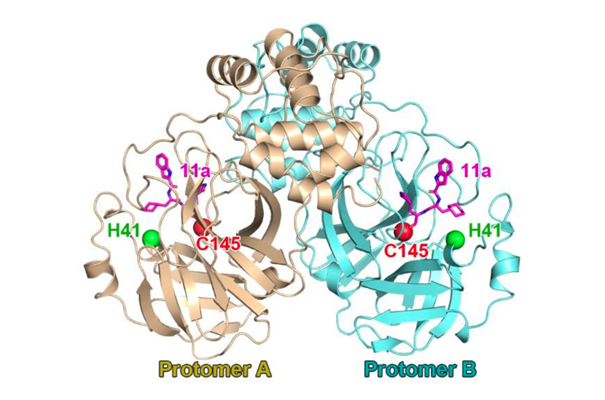
Sa nature « conservée » entre les différents genres/espèces de Coronavirus traduit son rôle critique pour le cycle viral ; et explique aussi que le GC376/373, développé contre la Mpro de FCoV, fonctionne aussi contre la Mpro de SARS-CoV-2
Chaque monomère de Mpro contient un site actif, au fond d’une cavité dans laquelle vient se positionner le substrat à cliver (polyprotéines virales).
Le site actif n’est constitué que de 2 acides-aminés !
Histidine en position 41 (H41)
Cystéine en position 145 (C145)
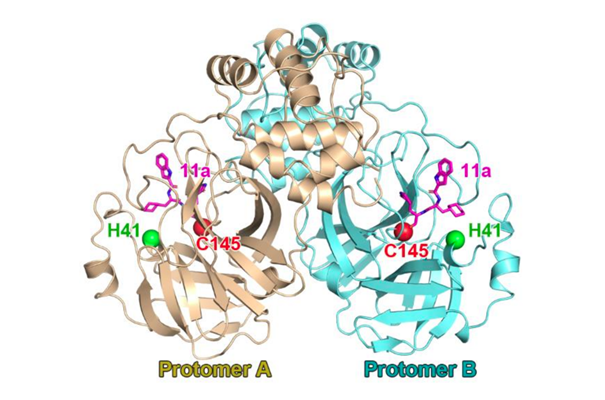
Le reste de Mpro sert à façonner sa structure 3D et contraintes physico-chimiques qui vont déterminer sa spécificité d’action (sur les polyprotéines virales) et les sites que Mpro va cliver sur ses polyprotéines…
Les clivages ne se font pas au hasard, mais sur des sites précis !
Les protéines sont composées d’une séquence d’acides-aminés, reliés par des liaisons peptidiques (peptide bond), orientées de l’extrémité N-terminale vers l’extrémité C-terminale…
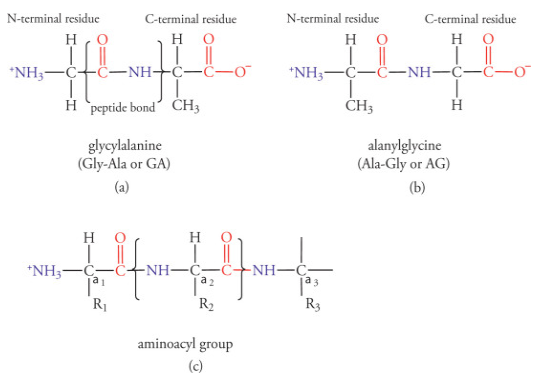
Si on reprend le schéma ci-dessus, imaginons la polyprotéine enchassée dans Mpro, et la section ci-dessous positionnée juste au niveau du site actif de Mpro.
Si on a une glutamine en R1, et un acide-aminé de petite taille en R2 🟪, alors Mpro coupe !
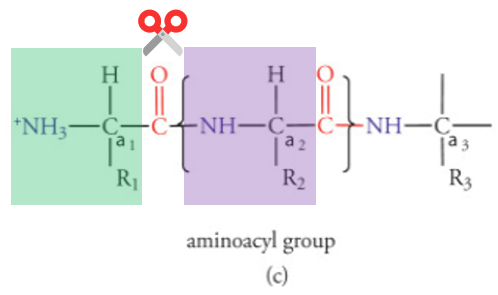
C’est bien gentil tout ça mais pourquoi on en parle dans un thread sur Paxlovid ???
Justement pour comprendre comment marche Paxlovid.
Vous allez voir, la chimie thérapeutique c’est fun !
Si on revient au schéma du nirmatrelvir (Paxlovid), on retrouve le groupement P1 qui se loge dans la poche S1 de Mpro, et établit 3 liaisons hydrogène avec les résidus Phe140, His163, et Glu166 de Mpro
https://www.nature.com/articles/s41401-021-00851-w
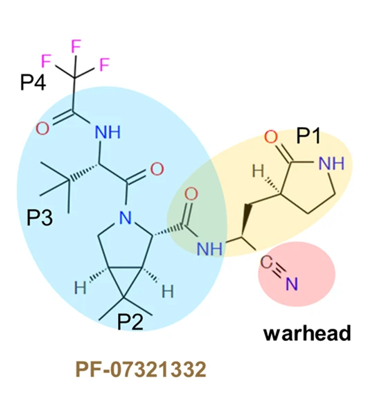
P1 agit comme un « leurre » qui mime la glutamine en position R1.
Ainsi, Mpro réagit comme si elle avait trouvé son site de clivage !
Sauf que le nirmatrelvir ne va pas du tout réagir comme une polyprotéine virale…

Le groupement « warhead » entre en jeu !
Il réagit avec la C145 du site actif de Mpro, en établissant une liaison covalente (forte mais réversible) qui bloque la fonction de Mpro (en empêchant l’accès des polyprotéines virales au site de clivage). /3/658/htm
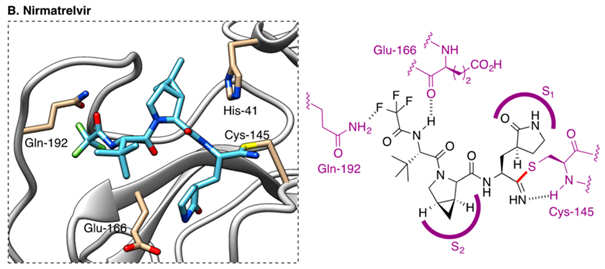
P2, P3 et P4 assurent la spécificité d’interaction entre le nirmatrelvir et Mpro.
P2 et P3 se logent dans les poches S2 et S3 de Mpro, et établissent une interaction hydrophobe avec les résidus Met149/Asp187 et Met165 respectivement….
P4 se loge dans la poche S4 de Mpro et y établit des interactions hydrogène avec le résidu Gln192 et 2 molécules d’eau. Il sert également à augmenter la biodisponibilité du nirmatrelvir par voie orale !
Intérêt de Paxlovid
Maintenant que nous avons décrit le mécanisme d’action de Paxlovid, on peut passer à la discussion sur l’intérêt et les limitations de ce traitement.
L’intérêt du Paxlovid passe par une administration la plus précoce possible après l’infection, afin d’obtenir un freinage précoce de la réplication, et donc de l’invasion virale… Ce freinage permet de limiter les dégâts tissulaires induits par le virus et/ou par l’activation de l’immunité cellulaire (notamment les lymphocytes T CD8+ et NK qui détruisent nos tissus infectés et provoquent lésions/inflammation+++)…
Si l’administration est suffisamment précoce, on obtient une baisse de 89% du risque d’hospitalisation/de décès, à la condition d’administrer Paxlovid dans les 5 jours maximum après l’apparition des tous premiers signes cliniques d’infection.
Limitations de Paxlovid
Ce qui nous amène rapidement aux nombreuses limitations de ce traitement !
Tout d’abord la nécessité d’une administration précoce.
Elle tient à son mode d’action sur Mpro et sur le mécanisme de protection qui vise à éviter l’activation virale de notre immunité cellulaire
On a vu plus haut dans le paragraphe Mécanisme d’action, la liaison qui s’établit entre la « warhead » du nirmatrelvir et le site actif de Mpro. Cette liaison est forte MAIS réversible.
C’est un 1er point faible, mis en défaut si nos cellules ont déjà eu le temps de produire beaucoup de polyprotéines virales…
Si l’administration du Paxlovid est trop tardive, les cellules contiennent alors beaucoup de polyprotéines virales qui entrent en compétition avec la « warhead » pour la fixation sur le site actif de Mpro.
Plus on tarde, plus l’équilibre bascule en faveur du virus…
Deuxièmement, plus on tarde, plus l’invasion virale a progressé dans les tissus et génère des stimuli activateurs pour notre immunité cellulaire. Plus elle s’active, plus elle induit une destruction étendue de nos tissus infectés = auto-destruction/inflammation…
Ce phénomène devient alors autonome et fait progresser la maladie indépendamment de l’activité virale.
On a alors beau administrer du Paxlovid, les dégâts sont déjà là, et la progression vers une COVID sévère ne peut plus être stoppée par un traitement antiviral.
Qui dit traitement précoce, dit nécessité d’un dépistage précoce !
Durant les essais cliniques c’était « facile », les participants étant surveillés+++ pour détecter les infections.
En vie-réelle, nous allons nous confronter à un gros problème = l’arrêt du dépistage 😅
De plus en plus de pays, comme la Suède, la France, l’Espagne, le Royaume-Uni… ont annoncé l’arrêt prochain du dépistage des infections à SARS-CoV-2, qui sera dorénavant, soit limité aux cas graves admis à l’hôpital, soit à une surveillance modélisée/syndromique type grippe.
Dans les 2 cas, Paxlovid n’est alors plus utilisable puisqu’il ne s’adresse qu’à une prise en charge très précoce, donc avec un dépistage facilement et rapidement accessible à l’échelle individuelle ; et bien avant la dégradation clinique conduisant à l’hôpital
Les choix de politique sanitaire visant à mettre l’épidémie sous le tapis en arrêtant le dépistage, risquent donc de compromettre l’efficacité (via accès précoce) de Paxlovid en vie réelle.
Elle sera probablement très inférieure à celle qu’on a observé durant les essais cliniques.
Pression de sélection
Autre problème, la pression de sélection !
Bien que Paxlovid contiennent 2 anti-protéases, un seul est actif contre SARS-CoV-2 (nirmatrelvir).
Il s’agit donc d’une monothérapie, contre un virus à ARN donc la caractéristique est de muter rapidement…
Ceci tend à faire ↘️ la barrière génétique à la résistance à l’antiviral, et favorise ainsi la sélection de mutants de sensibilité au nirmatrelvir baisse .
En cas de transmission, on observerait alors l’essor de variants résistants à Paxlovid.
Bien qu’elle soit conservée++ entre les genres/espèces de Coronavirus, la Mpro de SARS-CoV-2 mute !
Cela indique que la cible du Paxlovid peut évoluer tout en restant fonctionnelle. C’est une mauvaise nouvelle…
Pour l’instant, cette évolution est lente car il n’y a pas de pression de sélection sur cet antigène !
En effet, nsp5 (Mpro) n’est exprimée que DANS les cellules infectées…
C’est donc un antigène notamment ciblé par l’immunité cellulaire médiée par les lymphocytes T CD8+, capables de détruire les cellules infectées exprimant des peptides de nsp5 (Mpro) à leur surface…
En détruisant ces cellules, les T CD8+ n’exercent pas de pression de sélection car ils détruisent TOUS les virions contenus dans la cellule et ceux qu’elle aurait pu produire ! (que leur nsp5/Mpro soit mutée ou non) !
Le déploiement du Paxlovid dans la population va augmenter la pression de sélection.
Les virions porteurs d’une nsp5/Mpro insensible à l’inhibition par le nirmatrelvir, vont désormais avoir un avantage sélectif, c’est-à-dire mieux se répliquer/propager que les autres !
Ceci nous amène donc à un déterminant crucial de la stratégie de déploiement de Paxlovid = le limiter drastiquement aux patients qui ne peuvent pas bénéficier de la vaccination.
Plusieurs raisons à cela :…
Tout d’abord, plus il est largement déployé, plus la pression de sélection virale augmente.
Plus il est largement déployé, plus le risque de mésusage augmente (posologie/durée de traitement suboptimale favorisant la sélection de mutants résistants)… Ainsi, en limitant son déploiement à un nombre restreints de patients, on limite aussi le risque d’émergence/transmission de variants viraux résistants à Paxlovid. On préserve ainsi son efficacité pour les patients qui en auront le plus besoin.
Autre raison, la limitation en traitement précoce ! Il faudra donc un dépistage précoce de l’infection !
Or nous allons restreindre au maximum l’accès aux tests (la pandémie est « finie »…)… Or la circulation virale est loin d’être terminée ! Elle va se poursuivre durablement à haut niveau (évolution virale, optimum de transmissibilité/fitness ou d’échappement immunitaire pas encore atteints)… Donc on ne pourra pas déployer le Paxlovid pour la population générale, sinon la restriction des tests de dépistage ne pourra pas avoir lieu car il y aurait toujours une quantité énorme de citoyens à tester chaque jour pour initier leur traitement !
Autre raison de la limitation du déploiement = les risques majeurs d’interactions médicamenteuses !
J’attir l’attention sur ce point pour lequel la SFPT a émis des recommandations.
Interactions
Paxlovid contient du ritonavir, inhibiteur de nos cytochromes CYP3A4. Ceci peut conduire à de fortes perturbations d’autres traitements déjà en cours chez les patients.
Pour les traitements dont le principe actif est obtenu SANS métabolisation par les CYP3A4, Paxlovid peut ralentir+++ leur élimination et provoquer des surdosages = risque de toxicité+++…
Pour les traitements dont le principe actif n’est obtenu qu’APRES métabolisation par les CYP3A4, Paxlovid va au contraire réduire la formation de principe actif et provoquer des SOUS-dosages = risques d’inefficacité thérapeutique+++…
Mais les interactions peuvent se faire dans l’autre sens !
Des substances avec effet inducteur du CYP3A4 peuvent s’opposer à l’effet du ritonavir, et ainsi accélérer l’élimination du Nirmatrelvir ! On risque alors une inefficacité da Paxlovid par élimination trop rapide.
On ne peut donc pas délivrer le Paxlovid à la légère ! Les conséquences en termes de pharmacovigilance risqueraient d’être lourdes !
Coût/Efficacité
Autre raison à son déploiement limité : le rapport coût/efficacité !
Un traitement par Paxlovid coûte environ 600 € par patient, pour une efficacité théorique de 89 % à condition d’avoir une dépistage/administration précoce…
A cela, il faut ajouter le coût des tests (pour le dépistage précoce), la consultation médicale !
En face, on a des vaccins, dont l’efficacité est supérieure ou égale, pour un coût de seulement d’environ 20 euros par dose 😅…
De plus, l’efficacité des vaccins n’est pas conditionnée par un dépistage précoce/consultation médicale rapide en cas de symptômes;
On serait donc au-delà de l’absurde, si on privilégiait Paxlovid par rapport à la vaccination et ses rappels.
Pour toutes ces raisons, le Paxlovid doit être restreint aux patients à haut risque de COVID sévère ET ne pouvant pas bénéficier de la vaccination = rares cas de contre-indication à la vaccination, et immunodéprimés. Ceci est crucial pour espérer préserver l’efficacité de Paxlovid en limitant la vitesse d’apparition/diffusion de variants résistant à Paxlovid…
On doit aussi rester prudents car des variants ont déjà induit une baisse d’activité du nirmatrelvir.
On ne dispose pas encore de données contre Omicron ; or il est associé à une augmentation de la charge virale, ce qui pourrait influer sur l’activité de Paxlovid.
On dispose donc d’un nouvel outil, que nous devrons exploiter intelligemment si nous voulons pouvoir bénéficier de son efficacité, et ne pas le gâcher rapidement par induction de variants résistants !
Science infuse est un service de presse en ligne agréé (n° 0324 x 94873) piloté par Citizen4Science, association à but non lucratif d’information et de médiation scientifique doté d’une Rédaction avec journalistes professionnels. Nous défendons farouchement notre indépendance. Nous existons grâce à vous, lecteurs. Pour nous soutenir, faites un don ponctuel ou mensuel.



