Les cellules s’auto-cannibalisent régulièrement pour se débarrasser de leurs déchets. Cette autophagie contribue à leur survie et à la prévention des maladies
par Asa Gustafsson, Professor of Pharmacy and Pharmaceutical Sciences et Justin Quiles, Postdoctoral Scholar of Pharmacy and Pharmaceutical Science
University of California, San Diego, États-Unis
Ne vous laissez pas tromper par le schéma d’une cellule simplifiée en deux dimensions. Cette minuscule structure de la vie renferme un univers complexe de machinerie moléculaire qui se construit, se met en mouvement et se décompose en permanence. Ne vous laissez pas tromper par le schéma d’une cellule simplifiée en deux dimensions. Cette minuscule structure de la vie renferme un univers complexe de machinerie moléculaire qui se construit, se met en mouvement et se décompose en permanence.
Les cellules utilisent les milliers de protéines différentes qui les composent comme des outils pour façonner leur environnement interne. Dans cet environnement se trouvent des compartiments spécialisés, appelés organites, qui assurent les fonctions de la cellule. Deux organites importants dans les cellules sont les mitochondries et le réticulum endoplasmique, qui produisent de l’énergie et assemblent les protéines, respectivement.

Comme l’activité cellulaire de routine génère des sous-produits toxiques qui peuvent endommager la cellule, un système d’élimination est nécessaire pour dégrader et recycler ces molécules à l’intérieur des cellules. L’un de ces processus est l’autophagie, une forme d’autoconsommation que les cellules utilisent pour éliminer et recycler les composants anormaux ou excédentaires, notamment les protéines et les organites. Dérivé du grec, le terme se traduit littéralement par « s’auto-manger ». En 2016, le biologiste cellulaire Yoshinori Ohsumi a reçu le prix Nobel de physiologie ou de médecine pour ses travaux sur l’autophagie. L’autophagie est essentielle à la santé et à la longévité cellulaires. Lorsque ce processus ne fonctionne pas bien, il est lié à plusieurs maladies humaines, notamment les maladies neurodégénératives et cardiovasculaires et le cancer.
Nous sommes des chercheurs qui étudient comment l’autophagie est activée dans les cellules. Dans nos travaux récemment publiés, nous avons examiné deux régulateurs clés de ce processus et identifié un rôle unique que l’un d’eux joue dans la dégradation des mitochondries et qui pourrait servir de cible potentielle pour traiter certaines maladies.
Autophagie et maladies humaines
Le lien entre l’autophagie et les maladies est complexe et mal compris.
Par exemple, l’autophagie semble jouer un rôle paradoxal dans le cancer. D’une part, certaines études ont montré que, puisque ce processus supprime les tumeurs en éliminant les matières potentiellement dangereuses, une autophagie réduite ou altérée peut rendre une cellule cancéreuse. D’autre part, l’activation de l’autophagie après la formation d’une tumeur peut favoriser le cancer en l’aidant à s’adapter et à survivre, ce qui peut entraîner une résistance aux traitements.
Ces résultats suggèrent qu’il est particulièrement important de comprendre les étapes et le moment précis de l’autophagie lorsqu’il s’agit de cibler ce processus comme stratégie de traitement du cancer. Les chercheurs évaluent les effets anticancéreux de deux médicaments contre le paludisme, la chloroquine et l’hydroxychloroquine, qui bloquent les étapes finales de l’autophagie. Jusqu’à présent, leur efficacité varie selon le type et le stade du cancer.
Un dysfonctionnement de l’autophagie joue également un rôle important dans la plupart des maladies neurodégénératives. L’agrégation de protéines anormales dans les cellules du cerveau est une caractéristique commune de la maladie d’Alzheimer, de la maladie de Parkinson, de la maladie de Huntington et de la SLA. Certains scientifiques pensent que l’accumulation de ces protéines est due, au moins en partie, à un déclin de leur dégradation par autophagie.
L’autophagie est également importante pour la santé cardiaque. Les chercheurs ont constaté que l’autophagie dans le cœur décline avec l’âge et contribue aux maladies cardiovasculaires. La diminution de l’autophagie dans les cellules du muscle cardiaque entraîne une accumulation de déchets cellulaires qui peuvent affecter leur capacité à se contracter et même provoquer leur mort. Avec moins de cellules et moins de contraction, l’accumulation de matières toxiques dans les cellules du muscle cardiaque peut finalement conduire à une insuffisance cardiaque.
Destruction des mitochondries par la mitophagie
Pour que l’autophagie soit efficace, elle doit se débarrasser spécifiquement des seules protéines ou organites endommagés au sein de la cellule. Une dégradation incontrôlée priverait une cellule de ses besoins fondamentaux.
Cela est particulièrement vrai pour les mitochondries, car les cellules dépendent d’elles pour une grande partie de leur production d’énergie. Notre équipe s’est beaucoup intéressée à la manière dont les cellules s’assurent que l’autophagie des mitochondries, également appelée mitophagie, élimine uniquement les mitochondries dysfonctionnelles tout en épargnant les parties saines de la cellule. Une mitophagie dysfonctionnelle a été liée entre autres au cancer, à la neurodégénérescence et aux maladies cardiovasculaires.
Le processus d’autophagie débute lorsque la cellule commence à former une membrane à proximité des protéines ou des organites endommagés. Cette membrane se transforme en une vésicule, ou sac, appelée autophagosome, qui englobe le matériel endommagé. Il fusionne ensuite avec une autre structure cellulaire interne remplie d’acide, appelée lysosome, qui l’aide à dégrader sa cargaison.
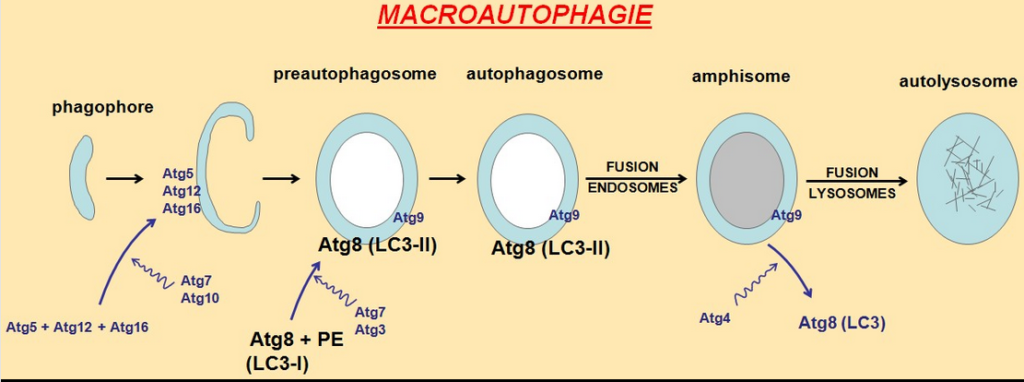
La bécline 1est une protéine connue pour favoriser la formation d’autophagosomes dans les cellules. Cependant, son rôle dans la mitophagie est controversé, en partie parce que l’on sait très peu de choses sur sa proche parente la bécline 2. Nous avons voulu démêler les fonctions de ces deux protéines et déterminer leur rôle dans la mitophagie. Pour ce faire, nous avons utilisé des modèles de cellules humaines et de souris pour examiner comment la présence ou l’absence de ces deux protéines affectait l’autophagie.
Nous avons découvert que l’activation d’une région unique de la bécline 1 lui permet de promouvoir la formation d’autophagosomes à côté des mitochondries dysfonctionnelles, facilitant ainsi leur dégradation dans les cellules humaines. Comme une région similaire n’est pas présente dans la bécline 2, cela signifie que seule la bécline 1 pourrait être essentielle à la mitophagie.
De manière intéressante, nous avons également pu observer la présence de la bécline 1 à des points de contact discrets entre les mitochondries et le réticulum endoplasmique pendant la mitophagie. Cela corrobore les recherches émergentes suggérant que les interactions physiques entre ces organites facilitent le transfert de certaines molécules nécessaires à la fabrication des autophagosomes. Nos travaux indiquent que seule la bécline 1 favorise l’engloutissement des mitochondries endommagées à ces endroits. La bécline 2 pourrait jouer un rôle différent dans l’autophagie et dans d’autres conditions.
Cibler l’autophagie pour des traitements
L’autophagie représente une cible thérapeutique potentielle pour de nombreuses maladies variées. Notre équipe étudie actuellement comment l’autophagie contribue à l’agrégation des protéines et au dysfonctionnement des mitochondries dans le cœur, et nous travaillons à la mise au point de nouveaux outils pour mesurer ce processus dans des modèles cellulaires et animaux.
Cependant, les stratégies thérapeutiques visant à réguler l’autophagie sont compliquées par le fait qu’il s’agit d’un processus complexe en plusieurs étapes qui implique de nombreuses protéines différentes. Certaines maladies peuvent nécessiter de cibler les premières étapes de la formation des autophagsosomes, tandis que d’autres peuvent nécessiter de se concentrer sur le moment où ils fusionnent avec les lysosomes. En outre, différents états pathologiques peuvent bénéficier de l’activation ou de l’inhibition de l’autophagie. Il reste encore beaucoup à faire pour identifier toutes les protéines spécifiques qui régulent chaque étape de la voie de l’autophagie et pour savoir comment les cellules régulent ce processus aussi bien dans une situation de bonne santé qu’en cas de maladie.
Nous pensons qu’en aidant les cellules à mieux exploiter le pouvoir de l’autophagie dans un univers moléculaire complexe, nous pourrons les entraîner à suivre les trois R : Réduire, Réutiliser, Recycler – pour favoriser la santé et la longévité.
Image d’en-tête : Illustration d’un autophagosome (double membrane bleu clair à droite) engloutissant du matériel cellulaire. David S. Goodsell and Daniel Klionsky/RCSB PDB-101, CC BY-SA
Pour aller plus loin
Texte paru initialement en anglais dans The Conversation, traduit par la Rédaction. La traduction étant protégée par les droits d’auteur, cet article traduit n’est pas libre de droits. Nous autorisons la reproduction avec les crédits appropriés : « Citizen4Science/Science infuse » pour la version française avec un lien vers la présente page.
Cet article GRATUIT de journalisme indépendant à but non lucratif vous a intéressé ? Il a pour autant un coût ! Celui de journalistes professionnels rémunérés, celui de notre site internet et d’autres nécessaire au fonctionnement de la structure. Qui paie ? nos lecteurs pour garantir notre ultra-indépendance. Votre soutien est indispensable.
Science infuse est un service de presse en ligne agréé (n° 0324 x 94873) piloté par Citizen4Science, association à but non lucratif d’information et de médiation scientifique.
Notre média dépend entièrement de ses lecteur pour continuer à informer, analyser, avec un angle souvent différent car farouchement indépendant. Pour nous soutenir, et soutenir la presse indépendante et sa pluralité, faites un don pour que notre section presse reste d’accès gratuit, et abonnez-vous à la newsletter gratuite également !
ou via J’aime l’Info, partenaire de la presse en ligne indépendante



