Traitement précoce du Covid-19 : et si c’était l’interféron lambda pégylé ? Une étude chez 2000 patients montre une réduction de 50 % des hospitalisations
Elle est parue ce jour dans la prestigieuse revue The New England Journal of Medicine, en voici un résumé.
Le traitement ambulatoire (sans hospitalisation) des patients atteints de Covid constitue un réel besoin. Il n’y a dans ce cadre que le Paxlovid (nirmatrelvir/ritonavir), antiviral en comprimés par voie orale disponible en accès précoce en France et que les médecins généralistes peuvent prescrire mais il faut le donner très vite, dans les 5 jours qui suivent les premiers symptômes. Les risques d’interactions médicamenteuses sont réels ce qui implique des précautions particulières et une surveillance. Le médicament n’est pas pour tout le monde. En outre, une étude publiée récemment modère l’enthousiasme du départ quant à son niveau d’efficacité.
Pourquoi l’interféron ?
Les interférons sont des molécules produites comme première ligne de défense par le système immunitaire en cas d’infection. Mais pour le SARS-CoV2 qui donne le Covid-19, on a constaté que la réponse des interférons naturels est faible. D’où l’idée de tester des interférons exogènes, comme l’interféron lambda pégylé.
L’intérêt potentiel des interférons c’est qu’ils sont activés de façon non spécifique, et ainsi un médicament à base d’interférons peut potentiellement être efficaces pour d’autres virus y compris celui de la grippe. On entrevoit ici le rêve d’un médicament universel utilisable quel que le virus de la prochaine pandémie.
Conception de l’étude
Il s’agit d’une étude de phase 3 randomisée contre placebo menée chez des patients ambulatoires à risque de Covid sévère, au Brésil et au Canada. Elle fait partie d’un essai de plateforme appelé TOGETHER qui a commencé dès juin 2020. Les essais de plateforme sont adaptatifs, c’est-à-dire qu’ils évaluent différentes molécules en fonction des opportunités. On a vu de tels dispositifs d’essais cliniques au Royaume-Uni et en France dès 2020 pour le Covid-19.
On peut s’étonner qu’il n’y ait pas de centres aux États-Unis, le fabricant du médicament expérimental, Eiger BioPharmaceuticals, étant américain. Pas de quoi séduire la FDA, l’autorité de santé américaine en charge des autorisations de mise sur le marché. Et puis on comprend mieux pourquoi : cette étude n’a pas été initié par le laboratoire mais par des chercheurs académiques. C’est à n’en pas douter une seconde faiblesse du point de vue du régulateur, et cela signifie du retard à la clé pour le fabricant car il faudra à coup sûr faire une étude avec des centres cliniques aux États-Unis pour pouvoir déposer un dossier d’enregistrement.
Mais passons sur cet aparté réglementaire. Les patients brésiliens et canadiens sélectionnés avaient reçu un diagnostic de Covid confirmé et des symptômes depuis 7 jours au maximum, ainsi qu’au moins un facteur à haut risque de forme sévère comme par exemple l’âge (plus de 50 ans), une hypertension, un diabète. 1949 patients ont ainsi été inclus dans l’étude au total, répartis de façon aléatoire dans un groupe interféron et un groupe placebo. Remarque : la plupart des patients étaient vaccinés contre le Covid-19 avec au moins une dose.

Le critère d’évaluation principal de l’étude était composite, constitué d’une hospitalisation en raison du Covid ou admission dans un servie d’urgences avec observation > 6 heures, dans les 28 jours suivant la randomisation.
L’interféron lambda pégylé (à la dose de 180 μg) était administré par injection sous-cutanée, et sous la même forme pour 825 patients ayant reçu le placebo, 193 patients ayant reçu le placebo par voie orale.
La moyenne d’âge des patients étaient de 43 ans (de 18 à 92 ans) et 57 % étaient des femmes. Les groupes sont équilibrés globalement en termes de caractéristiques démographiques et cliniques.
Voici le schéma de flux et de suivi des patients de la plateforme TOGETHER. À droite, on voit les autres traitements évalués, comme l’ivermectine et la fluvoxamine seule ou en association avec un corticoïde.
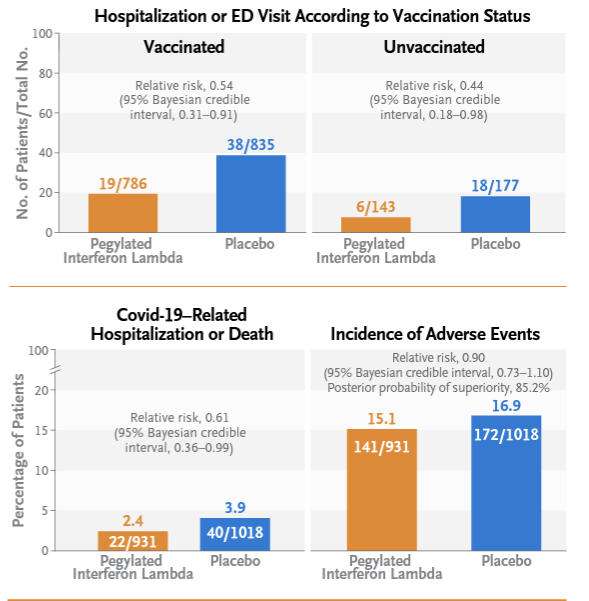
Résultats
Le risque d’hospitalisation pour Covid-19 ou d’admission aux urgences a été environ 50 % plus faible dans le groupe Interféron que dans le groupe placebo, et ce quel que soit le statut vaccinal. Néanmoins l’effet protecteur contre l’hospitalisation est nettement plus marqué chez les personnes non vaccinées.
En termes de sécurité d’emploi, l’incidence des événements indésirables étaient similaire dans les deux groupes de traitement.
Pour les amateurs, voici quelques données plus détaillées des résultats :
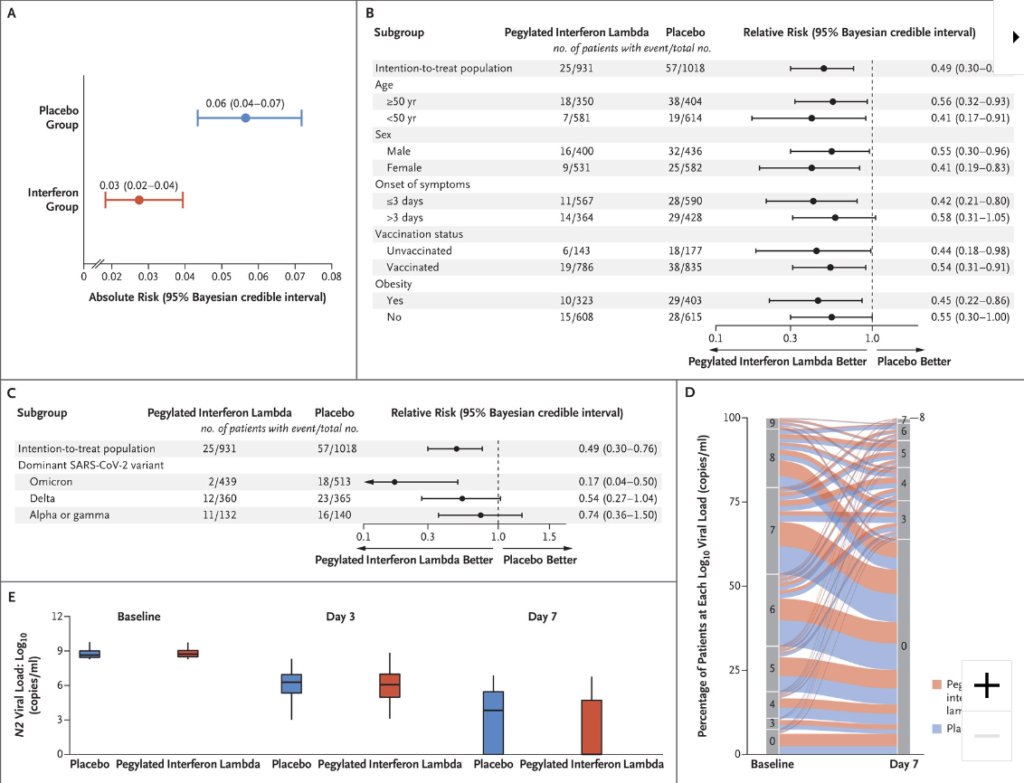
Ceux qui veulent aller plus loin iront lire la publication du New England Journal of Medicine.
Hypothèse (technique) en suspens
Les auteurs précisent que depuis la fin de cet essai, des recherches ont révélé qu’un polymorphisme dans le gène responsable de la réponse antivirale innée OAS1 a été lié à l’élimination du SARS-CoV-2, et qu’un haplotype commun pourrait indiquer une plus grande probabilité de réponse à l’interféron lambda pégylé et à d’autres interférons. En résumé, les auteurs pensent qu’il n’est pas impossible qu’on ait fait un bon choix en testant l’interféron lambda pégylé dans le Covid-19.
Et maintenant ?
Sur la base de ces résultats, on peut trouver ce traitement par interféron synthétique prometteur, avec une perspective de traitement à large spectre au moyen d’une simple injection sous-cutanée. Cela passe en ambulatoire. Il y a quand même des limitations avec une puissance faible de l’essai pour évaluer une réduction du risque de décès avec l’interféron, qui n’est pas significatif et reste donc une hypothèse. Et puis la polyvalence de l’interféron a aussi ses limitations : du fait qu’il se lient à de nombreux récepteurs dans l’organisme il sont associés (on étudie les interférons depuis longtemps) à pas mal d’effets indésirables. Mais l’avantage de l’interféron lambda pégylé, est qu’il est plus sélectif que les interférons naturels (type I), Cela explique peut-être le profil de tolérance favorable observé dans l’essai.
Aujourd’hui on ne peut s’empêcher de se dire : Et si on avait testé cet interféron synthétique au début de la pandémie, en 2020, voire 2021 ? Aujourd’hui on saurait ce qu’il vaut. En tout cas, on suivra avec intérêt les projets du fabricant sur la suite qu’il donnera à ce travail pour son produit.
Image d’en-tête : particules virales de SARS-CoV2 (jaunes) vues au microscope électronique à balayage (source Wikipédia)
Pour aller plus loin
Cet article GRATUITde journalisme indépendant à but non lucratif vous a intéressé ? Il a pour autant un coût ! Celui de journalistes professionnels rémunérés, celui de notre site internet et d’autres nécessaire au fonctionnement de la structure. Qui paie ? nos lecteurs pour garantir notre ultra-indépendance. Votre soutien est indispensable.
Science infuse est un service de presse en ligne agréé (n° 0324 x 94873) piloté par Citizen4Science, association à but non lucratif d’information et de médiation scientifique.
Notre média dépend entièrement de ses lecteur pour continuer à informer, analyser, avec un angle souvent différent car farouchement indépendant. Pour nous soutenir, et soutenir la presse indépendante et sa pluralité, faites un don pour que notre section presse reste d’accès gratuit, et abonnez-vous à la newsletter gratuite également !
ou via J’aime l’Info, partenaire de la presse en ligne indépendante